
电话:
021-67610176传真:
CAR-T细胞疗法已经在血液恶性肿瘤中显示出令人印象深刻的疗效。去年,美国FDA批准了两种靶向CD19的CAR-T细胞疗法,诺华的tisagenlecleucel(Kymriah™)用于白血病(2017年8月)和淋巴瘤(2018年5月),以及Kite Pharma的axicabtagene ciloleucel(Yescarta™)用于淋巴瘤(2017年10月)。
这也推动了在实体瘤中诱导相似功效的CAR的发展。然而,该过程在实现足够的功效之前,还面临着多个必须解决的挑战:
在实体瘤中CAR-T细胞治疗的众多挑战中,一个主要障碍是缺乏真正的肿瘤特异性靶抗原,这迫使细胞免疫学家靶向在肿瘤上过表达的肿瘤相关抗原(tumor-associated antigens, TAAs),但由于TAA也在正常组织和器官表达,具有安全风险。
此外,实体瘤的肿瘤微环境(tumor microenvironment, TME)特别是免疫抑制剂,阻止有效的抗肿瘤免疫应答。免疫抑制性TME含有多种成分,包括物理屏障,如致密的细胞外基质;功能失调的上皮细胞;代谢检查点,如缺氧;免疫屏障,如免疫抑制细胞因子/分子和免疫抑制性免疫细胞。
近日,CAR-T领域“大牛”宾夕法尼亚大学的Carl June教授在Frontiers in Immunology上发表了综述,针对目前CAR-T细胞治疗实体瘤的严峻形势,指出:为了有效地靶向实体瘤,必须同时解决影响功效和毒性的多种因素,深入了解CAR-T细胞生物学和影响CAR-T细胞疗法治疗窗的多种因素。
Carl June教授(图片来源:Philadelphia Magazine)
在这篇综述中,Carl June等人总结了CAR抗原识别机制的新发现,还讨论了调整和扩展治疗窗,使CAR-T细胞有效且安全地靶向实体瘤的合理策略。
或许,能给正在实体瘤CAR-T细胞疗法中挣扎的你一些有用的信息。
CAR-T细胞生物学基础知识
虽然已经深入研究了T细胞通过TCR与靶标相互作用的基本机制,但CAR与靶标相互作用的机制尚不清楚。CAR由TCR复合物和抗体的组合部分组成,因此讨论CAR与内源性、未修饰的TCR-T细胞的相似性,以及定义CAR的明显差异能更好地理解CAR-T细胞生物学。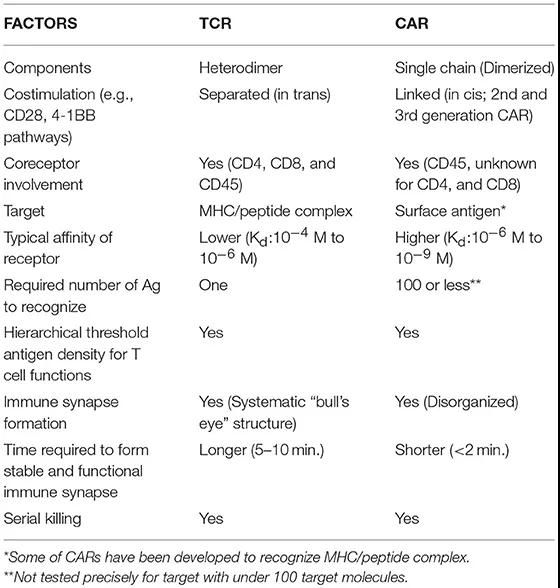
CAR-T和TCR-T细胞生物学因素的比较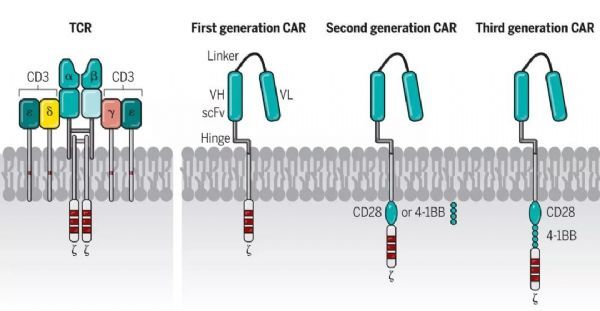
TCR与CAR的结构对比(图片来源:Science)
>>>>TCR
由TCRα和TCRβ亚基组成的异二聚体。每个亚基含有可变区结构域(V)和恒定区结构域(C),其后是跨膜区。每个V结构域含有三个互补决定区(CDR),其与主要组织相容性复合物(MHC)上呈递的肽相互作用。
TCR本身不具有信号结构域,需要由CD3复合物启动细胞内信号传导。CD3复合物由三个二聚体组成,分别是CD3ζε、CD3δε异二聚体和CD3ζζ同二聚体。
>>>>CAR
合成的嵌合蛋白,被引入T细胞以重定向抗原特异性并增强细胞功能。通常地,CAR由来自mAb的单链可变片段(scFv)、细胞外间隔区(称为铰链)、跨膜结构域、CD3ζ信号传导结构域和通常一或两个(第二代或第三代)共刺激结构域组成。
非典型构建的CAR利用受体配体或肽作为细胞外抗原识别结构域,例如zetakine CAR:白细胞介素-13受体α2(IL13Rα2)zetakine CAR。
CAR赋予T细胞以不依赖于MHC的方式通过scFv(抗体识别)直接结合表面抗原的益处。CAR可以通过CD3ζ和共刺激结构域同时向T细胞传递信号,这可以诱导T细胞的化学计算的和潜在理想的活化。
CAR如何触发免疫突触形成和传递信号?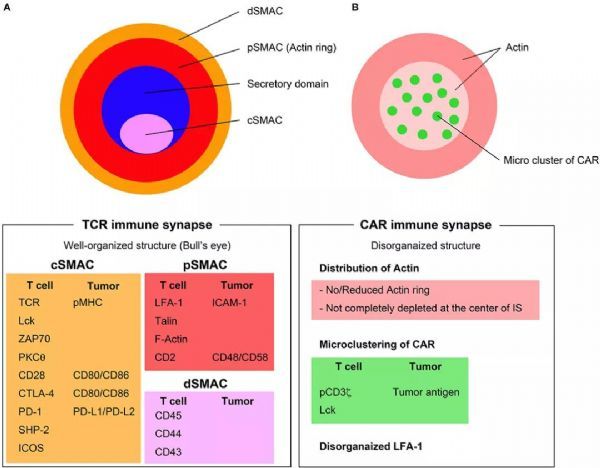
通过TCR和CAR形成免疫突触
>>>>
TCR IS
T细胞活化是通过TCR与MHC-肽复合物(称为IS)的高度有组织的和动态的相互作用介导的。成熟的IS是基于TCR信号的聚集体,诱导T细胞应答。
IS由三个同心的聚集分子环组成(图A):
IS的内环被称为中心超分子激活簇(cSMAC),其中发生TCR信号传导。cSMAC含有大多数TCR-MHC-肽复合物、CD28、PKC-θ和Lck;
外周SMAC(pSMAC)含有参与细胞粘附的蛋白质,例如整联蛋白LFA-1、细胞骨架连接子talin和ICAM1;
大分子,如CD43和CD45,被排除在pSMAC之外,构成远端SMAC(dSMAC);
裂解颗粒的分泌发生在细胞毒性T淋巴细胞(CTL)和靶细胞之间的IS变体(即分泌性突触)内。分泌性突触在cSMAC中具有两个独立且不同的结构域:(1)包含信号蛋白的信号传导结构域;(2)与细胞因子、穿孔素和颗粒酶的胞吐作用有关的分泌结构域。Stinchcombe等人证明,由Lck信号控制的瞬时极化和中心体对质膜的对接,在指导这种分泌的机制中具有重要作用。
此外,抑制和共刺激分子,如PD-1、CTLA-4和ICOS也在IS区域聚集,并在调节T细胞活化中发挥关键作用。
>>>>
CAR IS
CAR下游的细胞内信号传导和CAR形成IS的机制尚未得到广泛研究。
已经证明,在CD19特异性CAR-T细胞和靶细胞之间,ZAP70向IS募集以及CD45被排除在IS之外,类似于TCR活化。TCR的下游信号分子,如CD3ζ、LAT、Lck和ZAP70在CD19特异性CAR-T细胞被自体CD19+ B细胞激活后磷酸化。与第二代CAR-T细胞相比,第三代CAR-T细胞在TCR的下游信号分子上具有显著更高的磷酸化状态。
CAR IS(图B)与TCR IS的结构不同。CAR IS没有呈现出系统性的靶眼结构,而这是TCR IS的一个显著特征。CAR IS肌动蛋白(Actin)环的组织性很差,并且肌动蛋白在CAR IS的中心可能不会*消失。LFA-1紊乱,CAR肿瘤抗原复合物在CAR IS的微团簇形成随机分布。
TCR IS需要5-10分钟来形成靶眼结构,而CAR IS可能不需要形成这些稳定的结构,因为CAR IS的无组织多焦点模式足以快速诱导显著的近端信号传导,其发生在短时间内(<2分钟)。
IS生物学的另一个重要部分是将细胞毒性颗粒(包括穿孔素和颗粒酶)递送至由微管组织中心(MTOC)介导的IS。CAR的近端信号传导的快速但短暂的持续时间也诱导MTOC快速迁移至IS并加速颗粒的递送。
虽然CAR IS的机制已逐渐显现,但尚不清楚CAR IS结构的差异是否与CAR-T细胞的功效相关。
可溶形式CAR的配体,如CD30、间皮素和CEA,存在于单体形式不能触发CAR信令,因为它们不会引起CAR二聚化。然而,CAR-T细胞可能潜在地识别可以以寡聚形式存在的可溶性配体,例如TGF-β,甚至无需细胞-细胞相互作用。
CAR-T细胞识别的目标密度阈值是多少?
为了解决CAR激活阈值的问题,Watanabe等人研究了激活CD20特异性CAR-T细胞(CD28共刺激结构域)所需的CD20密度,其中每个靶细胞表达约200-250,000个CD20分子。在细胞内表达低密度CD20(约200个分子/细胞)的靶细胞即可被CAR-T细胞诱导裂解。该数据与之前的报道一致,即CAR靶向小鼠OTS8的肿瘤特异性糖表位,其可以裂解具有相似低密度(~200分子/细胞)靶抗原的靶细胞。
Watanabe等人还证明诱导T细胞增殖和细胞因子产生所需的靶抗原密度要高于诱导CAR介导的裂解所需的靶抗原密度。
总之,CAR-T细胞可识别具有相当低水平的靶抗原的靶细胞,并且它们具有针对细胞裂解、增殖和个体细胞因子产生的分级T细胞信号传导阈值。CAR构建体的差异(例如,scFv,铰链,共刺激结构域的亲和力)或CAR表达密度,可以用于更地控制CAR-T细胞活化。
CAR-T细胞是否可以作为连环杀手?
内源性T细胞和NK细胞可以连续裂解多个靶细胞(串联杀伤),这很可能*肿瘤所必需的。然而,直到近,CAR-T细胞介导连续杀伤的能力和靶细胞裂解的动力学才得到充分证实。
Davenport等人使用一种新的转基因小鼠模型测试了通过内源性TCR或异位表达的CAR激活的细胞毒性T淋巴细胞(CTL)的功能。他们使用定时显微录影术(time-lapse video microscopy)清楚地证明CAR-T细胞是连续杀手。大约22%的CAR-T细胞依次向两个或三个肿瘤细胞递送致死命中,并且通过CAR连续杀死的频率与通过TCR的频率相当。
肿瘤细胞裂解的动力学分析表明,在前20小时内,TCR和CAR介导等效的裂解动力学。但与20小时后TCR介导的裂解相比,CAR介导的细胞裂解动力学减慢。这种差异可以通过在抗原识别刺激后的CAR下调来解释,这可以通过基于TCR的CAR表达来改善。
CAR亲和力如何影响T细胞功能?
T细胞活化受TCR和MHC-肽复合物之间相互作用的调节,并且影响活化敏感性的主要因素是靶抗原密度和TCR亲和力。在微环境中肿瘤的主要免疫抑制机制是抗原识别失败,原因是低亲和力的TCR和癌症相关的肽-MHC复合物的相互作用。
TCR对自身衍生肽(如肿瘤抗原)的亲和力低于TCR对病原体衍生抗原的亲和力。因此,通常更难以分离对TAA具有足够敏感性的T细胞,这是过继性细胞疗法(ACT)的个障碍。
另一方面,TCR的高亲和力伴随着自身免疫应答,当患者接受ACT治疗时,有时会导致严重的不良事件。已经报道,ACT利用超生理的、高亲和力的TCR不能提高疗效,反而MHC-肽复合物的数量少能够实现高TCR占用,原因是单个复合体可以串联接合并触发数百个TCR。
总之,这表明一种模型,其中TCR的理想亲和力应提供足够长时间的相互作用来实现近端信号的传导,但也应适当地降低亲和力,以分离并允许尽可能多的TCR遇到MHC-肽复合物。
scFv亲和力对CAR-T细胞功能反应的影响仍未*了解。通常,与天然TCR亲和力相比,用scFv构建的CAR具有更高的亲和力。由于大多数TAA在肿瘤上高表达,在正常组织中低表达,增加CAR的亲和力将可能导致on-target/off-tumor效应引起的严重不利影响的风险,因此必须考虑刺激阈值以获得CAR-T细胞活化的*特异性。
与天然T细胞类似,CAR-T细胞也可以以连续方式杀死多个靶细胞。当通过CAR刺激而不是通过TCR刺激肿瘤细胞时,可以更快地消除肿瘤细胞,因为CAR可以比TCR更快地从垂死的肿瘤细胞中解离出来。因此,增加CAR-T细胞的亲和力可能减少/防止连续杀伤,促进T细胞衰竭,并减少中枢记忆和效应表型T细胞的产生和持久性,或通过激活诱导细胞死亡来增加T细胞的损失等一系列不利影响。
实体瘤靶抗原的筛选
ACT的关键是选择靶抗原,以提供足够的功效并使毒性小化。一些针对肿瘤特异性抗原的CAR已在临床前开发当中,包括针对异常糖基化癌基因的CAR,如MUC1的Tn糖型,以及肿瘤特异性活化形式的整合素,以及临床上,如CARs靶向胶质母细胞瘤中的肿瘤特异性转录变体EGFRvIII。
在没有更多肿瘤特异性靶标的情况下,CAR-T细胞疗法很可能选择继续靶向在正常组织中也表达的实体瘤TAA。实际上,大多数正在进行的针对实体瘤的CAR-T细胞疗法的临床试验都针对这样的TAA。
了解正常组织是否表达抗原及其表达水平以预测潜在毒性至关重要。
基于基因表达(RNA测序或微阵列)或免疫组织化学(IHC),可获得正常组织上抗原表达的几个公共数据库。但是,这些技术包含限制和陷阱。对于基因表达分析,非常罕见但关键细胞表达的抗原可能被低估。此外,可能无法区分表达的基因是来自组织还是来自浸润细胞。此外,假阳性和假阴性是尚未解决的问题,IHC对低表达抗原的敏感性可能不足以选择实体瘤的CAR靶标。
新技术,如单细胞RNA测序,可以提供更准确的表达谱,使研究人员能够更好地预测新型CAR-T细胞的功效和毒性。
扩大CAR-T细胞疗法治疗窗的策略
“治疗窗”是药物毒理学的术语,定义为功效和毒性之间的一系列剂量,实现高治疗益处并且不会导致不可接受的毒性。尽管工程化细胞与传统药物的药代动力学大不相同,但将治疗窗的概念应用于ACT领域对于优化治疗方法将是有价值的。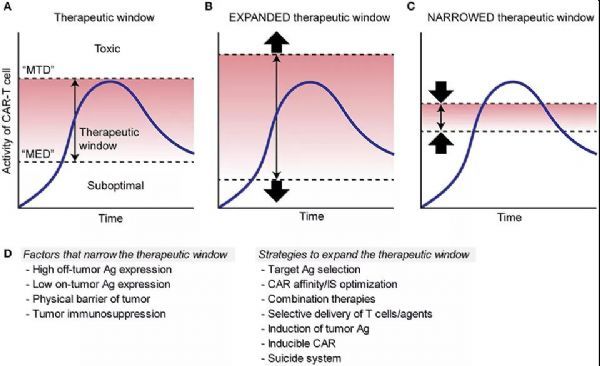
图解说明CAR-T细胞疗法的治疗窗
图A:小有效剂量(MED)和大耐受剂量(MTD)之间的范围;
图B:在CAR-T细胞疗法中,仅在肿瘤细胞上表达的靶向抗原或仅在非关键组织上表达的抗原扩大了治疗窗,因为不会对重要组织产生直接毒性;
图C:靶向在关键正常组织/细胞中表达的抗原通过降低MTD使治疗窗变窄。
不能仅基于抗原表达谱来解决治疗窗的确定。例如,即使在肿瘤和正常组织的抗原表达差异很大的情况下,其中抗原在肿瘤中以较高密度表达,但由于内在的免疫抑制,肿瘤可能仍然比正常组织对CAR-T细胞更具抗性。正常组织中不存在的TME。在这种情况下,肿瘤抑制T细胞浸润或诱导T细胞功能减退将通过增加MED来缩小CAR-T细胞的治疗窗。
鉴于真正的肿瘤特异性靶表面抗原尚未被发现,TAA可能是我们在可预见的未来的合理目标,因此,对于实体瘤的治疗,制定扩大CAR-T细胞疗法治疗窗的策略是必须的。
扩大治疗窗的可能方法包括:(1)优化CAR密度、亲和力和感应;(2)优化免疫突触形成;(3)联合治疗;(4)CAR-T细胞和治疗剂的局部递送;(5)诱导靶抗原表达;(6)其他修饰。
>>>>
优化CAR密度、亲和力和感应
尽管增加CAR亲和力使得能够识别与靶密度无关的抗原,但该作用可能引起严重的副作用,即on-target/off-tumor毒性,并降低连续杀伤靶肿瘤的能力。
因此,重要的是要制定合理的策略,以确定理想的CAR亲和力。
使用轻链交换技术构建亲和调节的scFv是测量CAR的*亲和力的可行方法之一。报道表明,CAR-T细胞的亲和力高于确定阈值不一定是必需的,或者更重要的是,通过产生对同一表位具有不同亲和力的CAR,并鉴定这些表位特异性CAR-T细胞表现出大的细胞裂解、增殖和安全潜力的低亲和力。
除了改变scFv亲和力外,调节表面CAR表达水平是诱导理想CAR信号传导的重要因素。CAR-T细胞功能受CAR密度和靶抗原密度控制,其中任一个的低表达都可导致CAR-T细胞的功能和灵敏度有限。
另一方面,CAR结构和高CAR密度可能导致产生CAR的连续信号传导(强直信号),然后通过增加T细胞分化、耗竭和活化诱导的细胞死亡(AICD)而诱导较差的抗肿瘤作用和T细胞的体内植入。因此,改善CAR密度同时保持表达低于强直信号诱导所需的阈值,可以诱导足够的抗肿瘤功效并保持对每种靶抗原和CAR构建体的安全潜力。
此外,可以通过肿瘤细胞上的两种不同抗原识别组合抗原。(1)“AND”逻辑门控CAR:仅在同时识别两种单独的所需抗原时才能*地激活CAR-T细胞。(2)“OR”逻辑门控CAR:CAR-T细胞通过表达两个CAR或具有串联抗原结合域的单个CAR,识别两种不同抗原中的任一种来驱动*信号传导。其中,“AND”逻辑CAR的工程T细胞能够实现更具特异性和更安全的靶向,“OR”逻辑CAR有潜力克服由于靶抗原丢失而导致的低靶抗原表达和肿瘤逃逸。
另一个有吸引力的平台是使用衔接分子开发“通用”CAR,以克服抗原表达中的肿瘤异质性并使CAR-T细胞的活化更具条件性。该平台转化为临床的一个潜在问题是衔接分子的免疫原性。
>>>>
优化免疫突触形成
如上所述,与组织性良好的TCR IS的靶眼结构相比,CAR IS更加杂乱,并且其特征在于Lck排列的多焦点模式、肌动蛋白环减少和LFA-1扩散分布。与TCR IS相比,CAR IS的显著能力实际上是即时诱导近端信号传导和细胞毒性颗粒的快速递送,其由MTOC向CAR IS的更快迁移介导。这些优势使CAR-T细胞能够快速从破坏的肿瘤细胞中解离,并介导有效的连续杀伤。
近,一些研究报告了关于CAR设计如何影响IS形成的重要发现。有研究使用由CD28或4-1BB共刺激结构域构建的CD19特异性CAR检测CAR IS质量,并确定CD28加4-1BB的第三代CAR优于基于CD28的第二代CAR,包括IS的结构、信号和功能。与双特异性CAR-T细胞相比,对两种神经胶质瘤相关抗原HER2和IL13Rα2特异的CAR表现出显著更高的F-肌动蛋白积累和MTOC极化得增加。
CAR IS的结构特征现在正在阐明当中,其调节将是CAR-T细胞治疗的一个很好的选择。已经有几种通过免疫调节药物(IMiDS)改善CAR IS的尝试,例如来那度胺-沙利度胺的合成衍生物。来那度胺通过增加肌动蛋白的积累提高了CAR功效,是一种有潜力增强CAR活性的联合疗法。
>>>>
联合疗法
联合疗法是一种通过克服肿瘤异质性和扩大治疗窗来推动CAR-T细胞治疗实体瘤的有希望的策略。
溶瘤病毒(OVs)是用于治疗实体瘤的有希望的药剂。OV特异性地靶向肿瘤细胞,同时对正常细胞不起作用,促使直接的肿瘤溶解,并激活免疫系统。此外,还可对OV进行基因修饰,使其在TME中选择性地表达治疗性转基因。OV在局部表达治疗性转基因的同时恢复抗肿瘤免疫反应的能力提供了与CAR-T细胞疗法组合的合理理由。
其他组合方法包括与对4-1BB共刺激受体特异的激动性抗体组合,其可以直接激活CAR-T细胞并且还可以减少宿主免疫抑制性免疫细胞,例如Tregs或MDSC。
>>>>
CAR-T细胞和治疗剂的局部递送
CAR-T细胞的全身性递送可能会受到对实体瘤的可及性的限制,还涉及安全性问题。因此,直接施用(局部给药)到肿瘤部位中是CAR-T细胞递送的一种解决方法。另一种方法是设计CAR-T细胞仅在肿瘤部位或主要在肿瘤部位起作用。
为了克服免疫TME,细胞因子和趋化因子,如IL-18、IL-12的局部递送,CCL19和IL-7的结合或表达检查点阻断剂的CAR-T细胞,可以帮助克服TME对T细胞浸润和功能的阻碍。临床前模型中已经证明了这些方法具有增强的治疗功效,同时能避免全身不良事件。
>>>>靶抗原表达的诱导
正如之前说的,靶抗原密度可以控制CAR-T细胞疗法的功效。
此外,靶抗原的丢失或下调是肿瘤逃逸的主要原因。靶细胞上抗原表达的诱导或再诱导可能是扩大治疗窗的有吸引力的方法。
据报道,亚致死剂量的辐射可诱导肿瘤细胞上TAA(如间皮素和CEA)的表达。此外,表观遗传控制也可以调节靶抗原表达,例如,抗甲基化药物氮杂胞苷(5-AZA)可以在治疗后重新诱导淋巴瘤细胞上的CD20表达,包括用靶向CD20的利妥昔单抗治疗后。
>>>>其他修饰
CAR-T细胞装备zi杀系统,例如诱导型caspase-9 (iCas9)或共表达截短的EGFR,将加强CAR-T细胞的安全性。这些系统可以通过施用相关药剂引发细胞固有细胞凋亡或细胞外源性抗体介导的细胞耗竭,从而诱导CAR-T细胞的消耗。
可诱导的CAR系统,包括TET诱导系统,它能够使用药物诱导控制CAR表达。
合成的Notch系统(synNotch)为CAR-T细胞的多样化和灵活性提供了另一个有吸引力的平台。SynNotch受体可以允许在抗原识别时向T细胞添加定制应答程序。 例如,synNotch可以在识别抗原时驱动定制的细胞因子分泌,偏向性的T细胞分化,或局部递送治疗有效载荷,如抗体。
结语
CAR-T细胞治疗实体瘤是复杂且多因素的,具有比用于治疗B细胞白血病和非霍奇金淋巴瘤的CD19靶向更窄的治疗窗。
尽管临床研究越来越多,但除了脑室内递送IL13Rα2CAR的胶质母细胞瘤外,很少有明显的疗效。在这种情况下,建立扩大治疗窗的策略显得至关重要。
肿瘤生物学、TME和CAR-T细胞生物学仍有许多未知数。幸运的是,解决这些问题的强大工具,如生物信息学、质谱蛋白质组学、大规模细胞计数和单细胞RNA测序等新兴技术,将使我们能够获得有关肿瘤、TME组分和免疫细胞的信息。
此外,基因编辑技术的成熟,例如CRISPR / Cas9系统,或合成生物学,例如synNotch系统,将能够帮助灵活地设计T细胞,有利于CAR-T细胞治疗实体瘤的突破。
当向患者施用新的CAR-T细胞疗法时,已经报道了几个具有意外严重毒性的病例。不幸的是,目前的技术不允许我们预测临床环境中的所有毒性。因此,目前只有临床试验可以揭示ACT的安全性和有效性信息。未来,持续开发和改进可以预测毒性的临床前模型,以及合理规划和实施临床试验,对于CAR-T细胞疗法的进一步发展至关重要。
参考出处:
frontiersin.org/articles/10.3389/fimmu.2018.02486/ful
science.sciencemag.org/content/359/6382/1361/tab-figures-data