
电话:
021-67610176传真:
人类基因组中大约有20000蛋白质编码基因,要定位出导致某种疾病的特定基因或途径,就好比大海捞针一样。肝细胞癌(HCC)的情况也是如此,研究发现HCC患者的癌症基因组中有超过10000个突变,因此开发有针对性的治疗方法极其困难。日前,由大阪大学的Tetsuo Takehara教授领导的研究小组利用一种新技术,可以找到与肝癌发展相关的基因和传导途径,使肝癌早诊率提高100%!他们的研究成果发表在《PNAS》杂志上。

在西方国家,非酒精性脂肪性肝病(NAFLD)是导致肝癌(HCC)发生率上升快的原因;然而,引起NAFLD-HCC的分子机制仍然是个未知数。为了确定NAFLD-HCC的分子驱动因素。
研究人员在肝脏特异性Pten基因敲除小鼠模型(PtenKO)和高脂饮食小鼠模型中进行了“睡眠美容”转座子突变筛选。(Pten基因编码由403个氨基酸组成的蛋白质,具有磷酸酯酶的活性。PTEN蛋白可通过拮抗酪氨酸激酶等磷酸化酶的活性而抑制肿瘤的发生发展。)
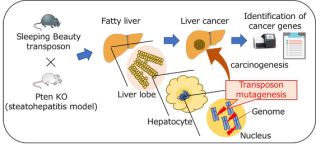
这项新技术涉及小型的、可移动的DNA序列“睡美人”转座子,它们被随机地整合到基因组中的两个不同的小鼠NAFLD模型中。转座子插入会破坏正常参与肿瘤抑制的基因,或者激活附近的癌基因,从而使研究人员能够通过受影响小鼠肝脏肿瘤加速或过度发育而发现潜在的HCC致病基因。
研究人员利用两种NAFLD-HCC小鼠模型的睡眠美容转座子突变,发现了数百个NAFLD-HCC候选癌基因,这些癌基因在与NAFLD和HCC相关的途径中得到丰富。
“在数以百计的候选基因中,我们发现Hippo路径中的Sav1基因是这两种睡美人屏幕中变异频率高的基因,”主要作者Takahiro Kodama表示。有趣的是,Sav1和Hippo通路还参与了器官大小的调节。如果这种通路被破坏,肝脏祖细胞就会不受控地反复复制,从而导致肿瘤的形成。
为了更全面地描述驱动NAFLD-HCC的基因和进化力量,我们首先在PtenKO小鼠上进行了SB诱变筛选,为了实现全基因组覆盖,我们使用两个高拷贝的SB转座子转基因系(T2Onc2;6113和T2Onc2;6070),分别从位于第1和第4染色体上的转座子中动员转座子,这是一个受遗传紊乱影响的NAFLD-HCC模型。
结果发现,带有SB转位的PtenKO小鼠5个月时开始发生肝脏肿瘤,所有的雄性和雌性小鼠分别在7个月和8个月龄时发生肿瘤,肿瘤数目和每个动物的大肿瘤体积也随着时间的推移而增加,在PtenKO/SB小鼠中显著高于PtenKO小鼠,这些数据清楚地表明,SB诱变加速了一个受基因突变影响的NAFLD模型的肝脏肿瘤的发展。
此外,在目前的研究中,研究人员发现在Sav1/Pten双突变小鼠模型中,新脂肪酸的合成和肝脏脂质的积累具有很强的激活作用,导致了NAFLD的进展。而Sav1基因是Hippo信号通路中常被SB转座子(睡美人)识别的突变基因,它通过抑制Hippo通路的下游效应因子Yap,与PI3K信号协同防止脂肪性肝炎的进展和随后的HCC的发展。
综上所述,通过比较两个NAFLD-HCC小鼠模型中SB诱变所确定的CCGs(筛选基因)列表,我们能够生成一个无偏颇的CCGs驱动NAFLD-HCC的目录。我们还证实了Sav1在NAFLD-HCC中的抑瘤作用,并确定了Hippo信号在NASH进展和肝癌发生中的作用。
这项技术可以通过敲除相关基因而鉴别出肿瘤分型并进一步阻断癌症的发展。我们知道在几乎所有疾病中基因突变都有关键性的作用,因此这项技术的应用前景非常广泛。随着科学家们对导致不同疾病的基因变异的了解日益深入,基因编辑工程的日益精进,目前人类无法治愈的疾病将会得到进一步突破,让我们拭目以待。
参考文献:
Takahiro Kodamaa, Jing Yib,Justin Y. Molecular profiling of nonalcoholic fatty liver diseaseassociated hepatocellular carcinoma using SB transposon mutagenesis
(转化医学网)