
电话:
021-67610176传真:
拉斯克奖被誉为诺贝尔奖的“风向标”,来自耶鲁大学的Joan Argetsinger Steitz教授因其40年来在生物医学领域,尤其是RNA生物学领域所发挥的领导作用而获得了2018年拉斯克奖医学特殊成就奖。本文中,小编就对近期科学家们在RNA分子生物学研究领域取得的研究成果进行整理,分享给大家!
【1】Nature:测量RNA速度可预测单个细胞的未来状态和终命运
doi:10.1038/s41586-018-0414-6
何给定器官的健康功能或引发疾病的功能障碍源于构成该器官的单个细胞的正常行为或行为异常。
近的技术进步使得科学家们能够一次一个细胞地分析细胞的作用,但是这些技术仅能产生细胞活性的静态快照。迄今为止,无需通过细胞冻存就可捕获单个细胞的行为用于预测它的未来一直是无法实现的。
如今,在一项新的研究中,来自美国哈佛医学院和卡罗林斯卡医学院的研究人员成功地将细胞决策作为一个动态过程加以捕获,在这个过程中,细胞决定着做什么和前往哪里。这种方法是一种数学模型,可用于估算RNA速度(RNA velocity)---RNA随时间变化的速率,这种RNA速度可在以小时计的尺度上作为细胞命运的预测因子。相关研究结果于2018年8月8日在线发表在Nature期刊上。
【2】Nature:重大进展!揭示RNA中调节蛋白表达的隐藏信号
doi:10.1038/s41586-018-0258-0
科学家们早就知道RNA会编码表达蛋白的指令。组成RNA的构成单元(building block)---碱基A、U、C和G---形成了细胞中蛋白制造复合物(protein-making machinery)的蓝图。为了表达蛋白,这种复合物结合到RNA的一端上,然后沿着RNA扫描,直到它到达AUG密码子,它是开始将遗传密码翻译成蛋白的信号。
在扫描RNA中的个AUG密码子期间,这种蛋白制造复合物经常遇到与AUG仅相差一个碱基的位点(比如AUA)。有时,蛋白合成从这些替代的起始位点开始。然而,这种蛋白制造复合物如何选择哪个替代位点来加以使用一直是个谜。
在一项新的研究中,来自美国凯斯西储大学等研究机构的研究人员描述了这种蛋白制造复合物如何选择哪些替代性起始位点来启动蛋白合成。相关研究结果发表在2018年7月5日的Nature期刊上。
【3】Nat Methods:开发出一种的新型定点RNA编辑方法,可用来替代CRISPR/Cas基因编辑方法
doi:10.1038/s41592-018-0017-z
CRISPR/Cas基因编辑工具的开发标志着靶向改变遗传信息取得的一次革命性进展。它为基础研究和基因修复提供了大量机会。然而,改变DNA也有风险---它所引起的任何错误将永jiu性地储存在基因组中,因此可能在较晚的时候给接受DNA改变的个体和他/她的后代带来问题。
德国蒂宾根大学跨学科生物化学研究所的Thorsten Stafforst教授及其团队7年来一直试图开发出一种低风险的替代方法:在RNA水平上进行靶向改变。这种新方法利用一种正常的细胞过程:编码在DNA中的遗传信息经转录后产生RNA,当RNA不再需要时,它便被降解掉。如果改变RNA,那么初始的遗传信息将仍然保留在DNA中。如今,在一项新的研究中,Stafforst团队能够利用这种替代方法地和地在细胞中编辑这些RNA转录本。相关研究结果发表在2018年7月的Nature Methods期刊上。
【4】Science:RNA结构决定着细胞中的相分离特异性
doi:10.1126/science.aar7432
生物学中长期存在的一个谜团是在一个细胞中碰撞的数百万个分子如何“找到”彼此并组装成一种功能性的结构。因此,当2008年美国伍兹霍尔海洋生物学实验室(Marine Biological Laboratory, MBL)生理学课程的参与者意识到简单的相分离(phase separation)---如从水中分离油---可能是在细胞内部创造秩序的一种重要方式时,这是一个巨大的惊喜。
虽然这个想法不是没有争议,但它已*征服了细胞生物学界。在过去的十年里,科学家们在从细菌到人类的许多细胞类型中观察到蛋白和RNA分子凝聚成液滴(droplet)或者说无膜凝聚物(membrane-free condensate)。他们还指出在健康细胞中形成液滴的相同蛋白能够在神经退行性疾病等疾病情形下发生“固化(solidfy)”。但是,是什么让相同液滴中的某些分子聚集在一起,并将其他分子排除在外,却一直没有得到解释。
【5】Nature:重大突破!从结构上揭示RNA聚合酶III转录起始机制
doi:10.1038/nature25441
根据需要读取和解析DNA密码的机制是所有的动物和植物所共有的,而且常常被癌症所劫持。在一项新的研究中,来自英国癌症研究院的研究人员通过使用低温电镜技术(Cryo-EM),以的细节放大和捕捉这种读取机制的图片。这项关于这种分子机制如何运行的发现可能为开发癌症治疗的新方法开辟新的途径。相关研究结果于2018年1月17日在线发表在Nature期刊上。
具体而言,这些研究人员以精致的和的细节捕捉一种被称作RNA聚合酶III(PolIII)的分子机器结合到DNA上、将它的两条链分开和准备转录DNA密码时的图片。
PolIII对所有真核生物(包括所有动物和植物)中的细胞是至关重要的。在癌症中,PolIII更加活跃,从而导致癌细胞产生更多数量的它们生长和增殖所需的构成单元(building block),如组成蛋白的氨基酸,这是因为它们快速地生长和分裂,因此它们能够变得极其依赖于PolIII复合物中的组分。
【6】Science:重磅!揭示环状RNA与大脑功能存在关联
doi:10.1126/science.aam8526
尽管上百种环状RNA(circular RNA, circRNA)在哺乳动物大脑中大量存在,但是一个重要的问题仍未解决:它们实际上发挥着什么作用?在一项新的研究中,来自德国马克斯-德尔布吕克分子医学中心的Nikolaus Rajewsky和他的团队将一种circRNA与大脑功能关联在一起。相关研究结果于2017年8月10日在线发表在Science期刊上。
RNA远不仅是DNA和它编码的蛋白之间的普通信使。确实,存在几种不同的非编码RNA分子。它们能够是长链非编码RNA(lncRNA)或短调节RNA(miRNA);它们能够干扰蛋白产生(siRNA)或者协助蛋白产生(tRNA)。在过去20年里,科学家们已发现了大约20种在分子微观世界中形成复杂网络结构的RNA种类。在它们当中为神秘的是circRNA,它们是一类不同寻常的RNA,这是因为它们的头部与它们的尾部连接在一起,形成一种共价闭合环。几十年来,circRNA被认为是一种罕见的外来的RNA种类。事实上,情况刚好相反。当前的RNA测序分析已揭示出它们是一种庞大的RNA种类,在大脑组织中高度表达。
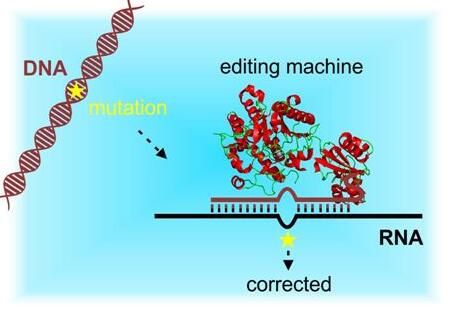
【7】Cell:重大突破!发现一类新的小RNA分子保护哺乳动物基因组
doi:10.1016/j.cell.2017.06.013
我们的基因组是雷区,散布着潜在破坏性的DNA序列,不过在这些DNA上,存在着数以十万计的哨兵在站岗。这些被称作表观遗传标记的哨兵在这些位点上附着到DNA双螺旋上,阻止这些DNA序列发挥着它们的破坏性作用。
大约一半的人基因组由这些破坏性的DNA序列组成。它们是古老的病毒和被称作转座子(transposon)和逆转录转座子(retrotransposon)的寄生性序列元件在长期的进化过程中自我整合到人基因组上的。令人吃惊的是,在生命周期的两个为关键的过程期间,这些哨兵被清除,让基因组处于裸露状态。这些哨兵会很快地回归,但仅在表观遗传石板被擦干净的一段时间之后才会回归。
如今,在一项新的研究中,来自美国冷泉港实验室(CSHL)的研究人员发现可能作为这些哨兵的应急替换,突击队仅在这些非常毫无防备的时刻才被强征在整个基因组中服役。特别地,在哺乳动物胚胎被植入母体子宫壁中之前,这些临时的保护者在哺乳动物胚胎发育的一个非常早期的期间保护它们的基因组。相关研究结果发表在2017年6月29日的Cell期刊上。
【8】Nature:揭示RNA剪接与衰老存在因果关联
doi:10.1038/nature20789
衰老是多种破坏性的慢性疾病的一种关键风险因素,但是影响细胞何时和如何快速地随着时间的推移发生恶化的生物学因素仍然在很大程度上是未知的。如今,由美国哈佛陈曾熙公共卫生学院(Harvard T.H. Chan School of Public Health)领导的一个研究团队将细胞剪接体---在一种被称作“RNA剪接”的过程中切割和重新连接RNA分子---的一个核心组分的功能与线虫的寿命相关联。这一发现有助认识剪接在寿命中的生物学作用,并且提示着操纵人类特定的剪接因子可能有助促进健康老龄化(healthy aging)。相关研究结果于2016年12月5日在线发表在Nature期刊上。
由于公共卫生取得进展,在*过去一个世纪,预期寿命显著增加。尽管人们一般能够活得更长,但是他们并不一定活得健康,特别是人们寿命的后十年。癌症、心脏病和神经退化性疾病等年龄相关疾病如今成为重要的健康负担---一个将可能只会恶化的问题。
机体---和细胞---为了维持年轻,它们必须也维持合适的稳态平衡。在细胞水平上,这意味着让生物信息从基因到RNA到蛋白的流动保持平稳和适当的平衡。
【9】Cell:科学家阐明RNA逃离细胞核后的“神秘旅程”
doi:10.1016/j.cell.2016.10.028
细胞会将其DNA牢牢锁定到细胞核中保护起来,这就好比藏在金库中的一个密码一样,然而对细胞核边界进行严格地控制或许是一件非常具有挑战的事情,对于细胞来讲其必须产生必要的蛋白质,而基于DNA的信息有时候会以RNA分子的形式采取某种方式逃离细胞核。
近日,一项刊登在杂志Cell上的研究报告中,来自洛克菲勒大学的研究人员通过研究确定了细胞中“限制闸门”重要组分的结构,该闸门能够允许很多物质通过,包括DNA转录形成的RNA遗传信息等。
【10】Nat Biotechnol:科学家们成功绘制出单细胞中短链RNA分子的图谱
doi:10.1038/nbt.3701
近日,刊登在杂志Nature Biotechnology上的一项研究报告中,来自瑞典卡罗琳学院的研究人员通过研究成功在单个胚胎干细胞中测定了短链非编码RNA序列的数量。当基因中的信息被使用时,比如当其编码蛋白质时,首先DNA会转录成为信使RNA来作为蛋白质制造的范本,我们的机体细胞中包含有大量的短链非编码RNA序列,这些序列并不能制造蛋白质,而且研究者也并不清楚这些RNA序列的功能,我们熟知的就是miRNAs了,其能够同信使RNA相互作用,并且调节基因和细胞的功能。
这项研究中,研究者对单个细胞中的短链RNA序列图谱进行了绘制,此前对短链RNA分子的研究基于同时对许多细胞进行分析,而这往往很难研究短链RNA分子的具体功能。研究者Rickard Sandberg教授说道,我们对短链RNA分子仅仅局限于一般的认识,而且我们还绘制了关于短链RNA分子一般机制的图谱,但这并不能够阐明这些分子在不同类型细胞或疾病中所扮演的角色。(生物谷)