
电话:
021-67610176传真:
LC-MS的强大功能已经得到了生物医学实验室的认可。1,2现在的LC-MS仪器已经从研究到常规临床实验室范围广泛使用,并有效应用于以下领域:
· 治疗药物监测 - 测量血浆,血液或组织中的药物(例如免疫抑制剂)
· 滥用药物测试 - 测量在尿液或唾液中的药物
· 激素测试 - 测量血清或血浆中的激素(例如类固醇或甲状腺激素)
· 生物胺分析 - 测量血浆或尿液中的生物胺(如儿茶酚胺)
· 新生儿筛查 - 通过使用LC-MS水平监测氨基酸和酰基肉碱检测婴儿可治疗的疾病
LC-MS仪器相对于其他分析工具具有很强的吸引力,原因在于该技术能够以非常高的灵敏度同时测量多种复杂分析物。此外,速度和信任也是患者护理的关键因素,同时成功的LC-MS生物医学分析具有高度灵敏度,可追溯性强和数据可靠的特性。因此,对于生物医学用LC-MS工作流程中的试剂水及其水在LC-MS成功分析实践中的作用将通过以下三个方面进行介绍。
灵敏度
超纯水被广泛用于LC-MS流程的各个环节(图1),所以是导致实验数据鬼峰,基线噪音和高MS背景等这些原因的主要污染源。同时也会使仪器或方法的灵敏度下降,使一些低浓度分析变的困难3。为了避免干扰,确保检测到的分析物是来自样品,而非来自实验用水4,实验过程需要使用高质量的超纯水,避免数据偏差和再次污染5。

Figure 1. The role of water in the LC-MS laboratory
超痕量分析是LC-MS生物医学分析中的一个应用领域,在激素检测中,相较于其他实验成分,其中水的使用量是非常大的。因此将Milli-Q水(电阻率18.2MΩ·cm(25℃),TOC<5ppb)作为激素中雌二醇分析的实例进行分析。这个实验的结果如图2所示,其中MRM色谱图显示Milli-Q®水中不存在雌二醇,确保了分析方法的低检出限,使用标准加入法测得雌二醇浓度为265.40ng/L。
前体离子273m/z和碎片离子255m/z用多反应监测(MRM)ESI+转换。HPLC和MS以及LC-MS/MS的仪器参数以及制备Milli-Q®水所用水源,见图2。
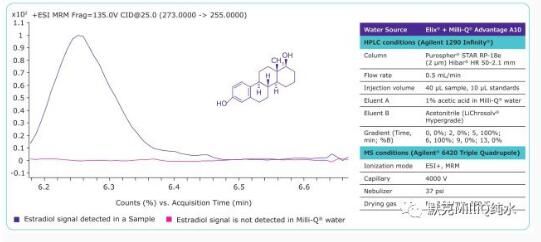
Figure 2. MRM chromatogram (ESI+) of estradiol in a sample and in Milli-Q®water.
可追溯性
水纯化系统的在线监测功能使科学家们确定他们所使用的水是否符合LC-MS分析的要求。但是,当问题产生时,说明LC-MS分析过程中已经出现了污染,找到并消除其来源至关重要,因为污染隐患来源非常多,使用LC-MS实验时收集记录的水质参数的数据可以在特定的日期与污染源联系起来,从而促进水质评估和问题的排查。
而且,在所有临床实验室中,可追溯性都是质量管理体系中的重要需求,能使实验室符合认证,例如,ISO15189:2007标准或CLSI®C3—A4。所以,在这种情况下用电子方式记录水质参数的方法是一种确保高质量认证的解决方案。
可靠性
为了满足LC-MS生物医学实验室的要求,水源必须可靠。所以水纯化系统不仅要生产高质量的实验用水,而且这个质量必须始终如一。为确保水质的一致性,使用在线监测工具。水中的离子含量通过电阻率测量来评估,通常电阻率18.2MΩ·cm(25℃)的水表示不含离子杂质。
为了检测有机污染物程度,可用可氧化总有机碳(TOC)计算;TOC低于5ppb的水(或μg/L)适用于LC-MS实验。因此,要检测水质的稳定性需要连续监测Milli-Q®水质的电阻率和TOC参数。图3显示了Milli-Q®系统提供的水质稳定性在线监测数据。
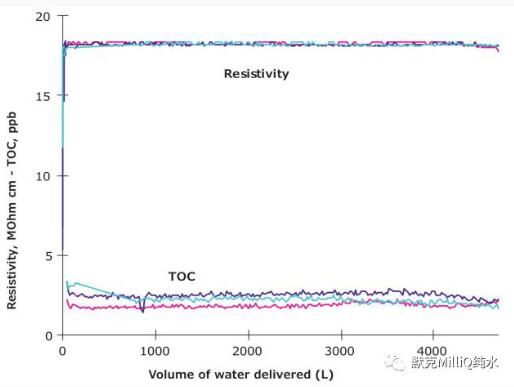
Figure 3. Levels of Resistivity (MOhm·cm) measured continuously and TOC (ppb) measured every 3 minutes as a function of volume produced by a Milli-Q® water system. Different colors refer to data obtained for three different sets of consumables installed by turns.
结论
超纯水适用并符合LC-MS生物医学分析实验的要求,而且良好的水质对实验的高质量和稳定性至关重要。临床实验室LC-MS实验 可以使用Milli-Q®水净化系统即能符合LC-MS仪器高灵敏度的要求还可以获得可靠和可追溯的分析结果。
References
1. K. S-Y. Leung, B. M-W. Fong, LC–MS/MS in the routine clinical laboratory: has its time come? Analytical and Bioanalytical Chemistry, 406, 2289-2301 (2013).
2. M. Himmelsbach, 10 years of MS instrumental developments--impact on LC-MS/MS in clinical chemistry, J. Chromatogr. B, 883– 884, 3– 17 (2012).
3. A. Khvataeva-Domanov, S. Mabic, Four Ways to Better Water Quality in LC-MS, R&D Magazine, (2015);
4. CLSI®C62-A - Liquid-Chromatography-Mass Spectrometry methods; approved guideline, Johns Hopkins Medical Institutions, First Edition, 5.3.1, 34, (2014)
5. Controlling Contamination in UltraPerformance LC?/MS and HPLC/MS Systems, Waters Corporation;
6. B. Keller, J. Sui, A.B. Young, R.M. Whittal, Interferences and contaminants encountered in modern mass spectrometry, Anal. Chim. Acta, 627, 71-81 (2008).
7. M. Vogeser, C. Seger, Pitfalls associated with the use of liquid chromatography-tandem mass spectrometry in the clinical laboratory, Clin. Chem. 56, 1234-1244 (2010).
8. Millitrack? e-Solutions, A unique set of data management and monitoring software solutions for water purification systems, MilliporeSigma;